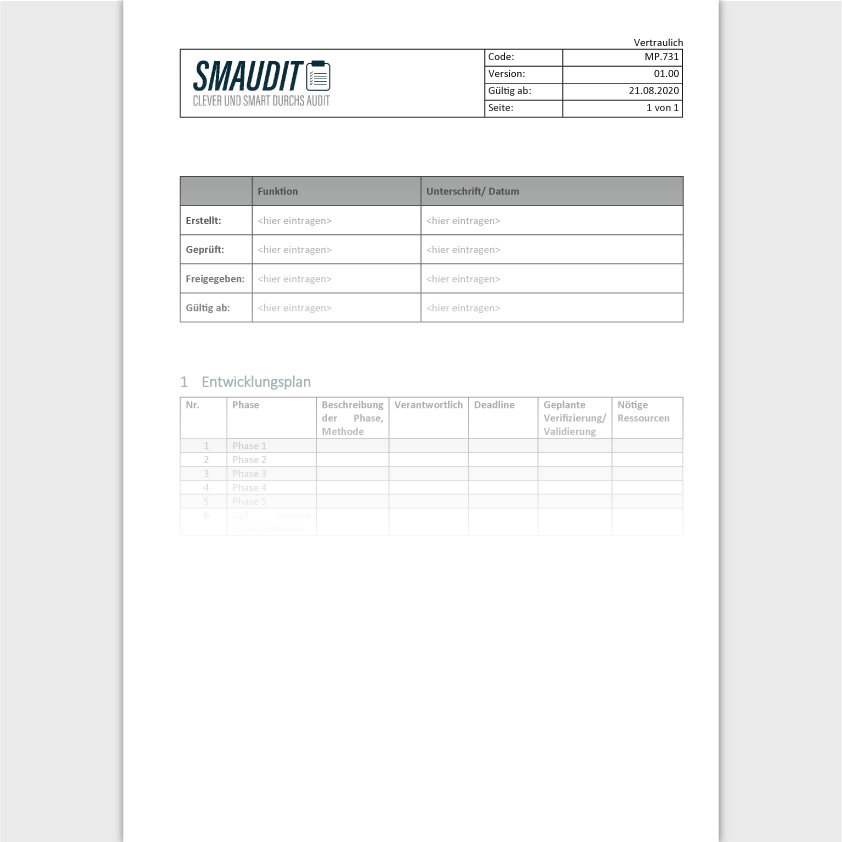
Diese Vorlage enthält die Eingaben, die Sie benötigen um eine Entwicklung für ein Medizinprodukt nach DIN EN ISO 13485:2016 zu planen und dies entsprechend zu dokumentieren.
0 Bewertungen
Per Norm DIN EN ISO 13485:2016 wird gefordert, dass in Ihrem Qualitätsmanagementsystem (QMS) sämtliche Prozesse schriftlich beschrieben werden.
Diese Prozessbeschreibungen werden häufig SOP genannt. Sogenannte SOPs (englisch für Standard Operating Procedure) sind die Beschreibung Ihrer Standardvorgehensweise für die einzelnen Prozesse. Pläne, Nachweise oder Protokolle bedürfen in einem implementierten QMS einer Vorlage, die sogenannten Formblätter, oder auch F&T (Abkürzung für englische Forms & Templates). Diese F&Ts werden zum Ausfüllen für verschiedene Anwendungen wie beispielsweise Prüfprotokolle, Auditpläne oder Risikoanalyseberichte genutzt.
Diese Vorlage enthält die Eingaben, die Sie benötigen um eine Entwicklung für ein Medizinprodukt nach DIN EN ISO 13485:2016 zu planen und dies entsprechend zu dokumentieren.
Passende Webinare und Schulungen
Artikelnummer: MP.731
offene Dateiformate
individualisierbar
abgestimmte Vorlagen, Checklisten und Formblätter
Es liegen noch keine Bewertungen vor.